Publié le
Lecture 16 mins
Intelligence artificielle et dépistage par mammographie du cancer du sein : entre faits et promesses…
Patrice TAOUREL, Département d’imagerie médicale Lapeyronie, CHU de Montpellier
Le 27 octobre 2016 à Toronto, au Canada, Geoffrey Hinton, une des stars de l’intelligence artificielle (IA) affirmait qu’il fallait cesser de former des radiologues car les algorithmes les auraient dépassés avant 5 ans. Plus de 7 ans après, force est de constater que l’IA a relativement peu changé la pratique clinique des radiologues.
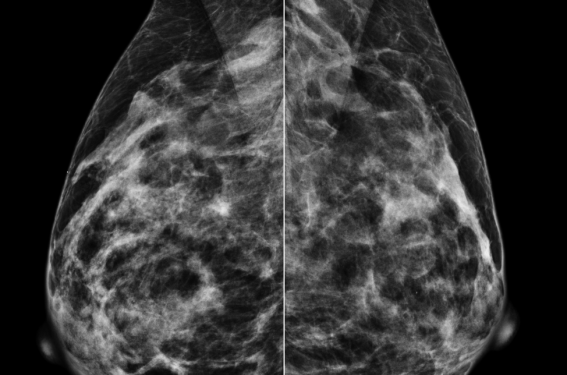
L’année dernière, le Comité consultatif national d’éthique insistait sur la difficulté à distinguer faits et promesses, et en matière d’imagerie, que ce soient la radiologie, l’anatomopathologie, la dermatologie ou l’ophtalmologie, les promesses de l’IA sont nombreuses. Le dépistage du cancer du sein par mammographie représente un champ dans lequel l’IA prendra, à n’en pas douter, une place importante dans les années à venir. Plusieurs faits expliquent pourquoi la mammographie représente un secteur privilégié du développement de l’IA : – le cancer du sein constitue une pathologie fréquente avec un diagnostic reposant essentiellement sur l’imagerie ; – les acquisitions en mammographie sont standardisées (face, oblique) ; – le volume de données digitalisées accessibles est très important ; – les bases de données du dépistage constituent un outil robuste pour classer les patientes comme porteuses ou non d’un cancer du sein ; – le lexique BIRADS d’interprétation est largement utilisé et de façon plutôt reproductible ; – le dépistage et la mammographie s’intéressent à une seule maladie : le cancer ; – les systèmes de CAD (Computer-Aided-Detection) ont commencé à être développés il y a plus de 20 ans. Malgré cet enthousiasme et des projections très positives quant au rôle de l’IA, l’histoire du CAD aux États-Unis doit amener à beaucoup de prudence. En effet, le premier agrément de solution de CAD par la FDA date de 1998 avec, dès lors, un financement par des systèmes assuranciels. En 2015, 90 % des cabinets de radiologie étaient équipés de CAD aux États-Unis. Néanmoins, plusieurs études ont démontré que l’utilisation de ces CAD entraînaient une baisse de la spécificité avec une augmentation de 20 % du nombre de biopsie (1) ; mais également, et de façon beaucoup moins intuitive, que l’utilisation du CAD entraînait une baisse de la sensibilité de 6 % dans une étude publiée en 2015, dans le JAMA sur plus de 320 000 femmes (2). En 2015, cette première expérimentation à l’échelle des États-Unis s’est conclue avec la fin du remboursement du CAD. Les systèmes d’IA, aujourd’hui, sont très différents des CAD développés il y a plus de 30 ans, ils sont construits avec une quantité de données beaucoup plus importantes et à partir de technique de deep learning dont la compréhension profonde est au-delà de l’article proposé ici. Nous détaillerons au cours de cet article les différents niveaux dans lesquels l’IA pourrait être utile en mammographie : – IA en substitution du radiologue ? – IA en support du radiologue ? – IA pour éviter des interprétations du radiologue en simple ou en double lecture ? – IA pour diminuer le nombre de cancers de l’intervalle ? – IA pour la mesure de la densité mammaire ? – IA comme prédiction du risque à venir du cancer du sein ? – IA avec des performances équivalentes pour tous les logiciels développés sur le marché ? – IA dans la réalisation et le contrôle qualité de la mammographie ? Pour répondre à ces différentes questions, à côté d’une approche objective et synthétique de la littérature, nous ferons état de façon parfaitement subjective de notre expérience pratique puisque nous utilisons depuis presque 3 ans un logiciel d’IA, le logiciel Transpara, qui est le plus utilisé et donc le plus évalué dans les publications disponibles sur l’IA en mammographie. L’intelligence artificielle à la place du radiologue (décrit dans la littérature anglo-saxonne comme IA stand alone) Le principe de cette option est de remplacer le radiologue par l’IA qui interpréterait toutes les mammographies. De nombreuses publications évaluent cette option depuis près de 5 ans avec des résultats disponibles principalement sur la mammographie 2D, beaucoup moins sur la tomosynthèse, et pas sur la reconstruction synthétique. Les résultats sont très variables, il y a eu une première période d’enthousiasme symbolisée par une étude publiée dans la très prestigieuse revue Nature (3). Cette étude promue par la firme Google concluait à une supériorité de l’IA par rapport aux radiologues. Mais comme l’a clairement noté le Pr Isabelle Thomassin dans une analyse publiée sur www gyneco-online.com (Le futur de l’imagerie, l’émergence de l’IA et son apport en mammographie, février 2020) : si le modèle de détection par IA dans l’article publié dans Nature était implémenté sur une cohorte de plus de 500 000 femmes, la comparaison IA/performance humaine a été conduite sur 500 femmes avec des chiffres de sensibilité dans la détection du cancer du sein pour certains radiologues très bas (autour de 50 %) et avec une incidence du cancer 3 fois supérieure à celle attendue du dépistage. Cette étude montre à mon sens un manque de rigueur méthodologique possible même dans certaines revues très prestigieuses mais également le poids important de l’industrie (ici Google) dans les publications scientifiques malgré la très forte sélectivité académique. Ces limites méthodologiques ont été récemment très bien analysées par une revue systématique portant sur 12 études qui évaluent 36 solutions d’IA. Cette revue mettait en lumière le faible niveau méthodologique de la plupart des études publiées avec des risques de biais méthodologiques, des doutes quant à l’applicabilité en routine clinique et concluait que 94 % des logiciels d’IA étaient moins performants qu’un radiologue (4). Le journal Le Monde titrait sa chronique : « L’œil de l’IA moins affûté que celui des médecins » alors que trois ans plus tôt, il avait titré « L’IA : as du diagnostic médical ». Une méta-analyse publiée en mai 2023 (5) retrouve des résultats beaucoup plus positifs ; elle inclut finalement, 16 études avec plus d’un million d’examens de dépistage et près de 500 000 patientes et montre une sensibilité supérieure de 7 % de l’IA par rapport à la lecture des radiologues au prix d’une diminution de spécificité de 4 %. Cette perte de 4 % de spécificité pose cependant de gros problèmes dans l’utilisation de l’IA pour remplacer le radiologue dans le dépistage de masse organisé. Dans notre pratique clinique, le nombre d’examens anormaux pour masse séquellaire postopératoire, distorsion architecturale ancienne, macrocalcifications, microcalcifications de nature vasculaire, ou tout simplement clip rend absolument impossible l’utilisation de l’IA à la place du radiologue car cela entraînerait trop de faux positifs à gérer. La limite de ces différentes méta-analyses est qu’elles incluent des articles évaluant des solutions d’IA qui sont de niveau hétérogène aujourd’hui, même si elles sont développées sur le marché. Les résultats dépendent également de la performance et de l’expertise du radiologue auquel la solution d’IA est comparée. Une étude, dont la population est enrichie en nombre de cancers du sein, comparant l’IA aux performances de 101 radiologues est éclairante à ce propos (6). Si l’IA seule était supérieure à la lecture par le radiologue en moyenne, 35 % des radiologues faisaient mieux que l’IA. Les études focalisées sur la tomosynthèse sont beaucoup moins nombreuses et dans la méta-analyse très récemment parue (5), quatre études étaient relevées. Elles montrent des performances supérieures de l’IA en termes de surface sous la courbe, mais au prix d’une spécificité nettement diminuée, en effet si le gain en sensibilité était de 10 %, la perte en spécificité était de près de 20 % avec une spécificité de l’IA de seulement 63 % rendant impossible l’utilisation de l’IA seule dans l’interprétation de la tomosynthèse en dépistage de masse organisé. Enfin, dans un nouveau dépistage à la française substituant à l’imagerie 2D, la reconstruction 2D synthétique, il n’y a pas de donnée solide pour évaluer les performances de l’IA en imagerie 2D synthétique. En synthèse il n’y a pas aujourd’hui de place pour l’IA en substitution du radiologue dans le dépistage du cancer du sein par mammographie : les performances ne sont pas supérieures, les logiciels d’IA ne sont ni équivalents ni arrivés à maturité, le manque de spécificité rendrait inopérante une action de santé publique comme le dépistage, et enfin la question du responsable (radiologue ? développeur de la solution d’IA ?) serait prégnante en cas d’erreur diagnostique. L’intelligence artificielle en support du radiologue Dans ce cadre, les radiologues utilisant l’IA en support de leur lecture, à l’origine du concept de radiologue augmenté. Les conclusions issues de la littérature sont tout à fait concordantes : le radiologue aidé de l’IA a des performances supérieures à celles du radiologue seul ou du logiciel d’IA seul, avec une augmentation de la sensibilité comme de la spécificité. Le gain de sensibilité pouvant aller jusqu’à 10 % (figure 1) alors que les gains de spécificité sont plus modestes (7). Ce gain à la fois en sensibilité et spécificité, rare lorsqu’est évaluée une nouvelle technique d’imagerie, doit être souligné. À notre avis, pour utiliser pleinement le potentiel de l’IA, les conditions d’interprétation de la mammographie par le radiologue doivent être strictes : la mammographie doit être lue et interprétée par le radiologue dans un premier temps, puis les résultats de l’IA devront être regardés et les différentes marques montrées par l’IA analysées. Cette analyse est faite de façon relativement confortable dans notre expérience, puisque la lésion individualisée par l’IA est marquée, d’une part, avec une marque différente selon qu’il s’agit de microcalcifications ou d’une autre lésion identifiée, la présomption diagnostique est chiffrée sur une échelle numérique par l’IA et enfin lorsqu’une lésion a été identifiée sur la tomosynthèse le numéro de la coupe où la lésion a été dépistée par l’IA est donné. a. b. c. d. e. Figure 1. Tumeur subtile supéro-externe gauche bien vue grâce à l’IA. Aucune lésion n’est évidente ni sur les clichés obliques (a), ni de face (b). L’IA identifie une masse de siège supéro-externe gauche sur la face et l’oblique gauche et sur la tomosynthèse en donnant le numéro de coupe ou la lésion est vue (c). A
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :
Articles sur le même thème
Pagination
- Page 1
- Page suivante